わたしたちの使命は、高いプロフェッショナリズムを保持した研究者として後世に残る知的財産を作ることです。とりわけ脳高次機能疾患である精神疾患の原因解明および根治的治療薬の開発に挑戦しています。医学の進歩した現代において謎のまま残されている疾患はもはや多くありませんが、その中で未だに解明されておらず、謎に包まれている疾患の代表が精神疾患です。うつ症状・不安・妄想・幻聴などの精神症状を呈する精神疾患は、診察室での対話による病歴聴取・症状評価により主観的に診断され、治療に関して言えば、ほとんどの精神疾患には向精神薬による対症治療が行われていますが、これらの薬はいずれも偶然発見された薬とその改良版であり、病態機序に立脚して設計された薬とは言い難いのが現状です。精神疾患の原因解明がこれほどまでに困難なのは、ヒトを対象とした精神疾患研究では、患者サンプルを用いたナノスケールのゲノム解析と、これとは全く対極のマクロスケールであるfMRIなどの脳画像研究が二極化した状態で進行していること、さらに倫理的な制約から脳組織を生検などで直接検証することが不可能だからです。したがって病態生理や治療標的の中核となりうるマイクロメートルスケール、すなわちシナプス・細胞レベルの病態を解明する手法が極めて限られていました。様々な疾患関連遺伝子や死後脳所見など報告されていますが、これら知見はまだ観察レベルの記述的記載と言わざるを得ません。そのため、これらのナノ・マイクロレベルの階層が、より上位のマクロレベルの階層へ、如何なる相互作用を惹起しながら最終的に行動変容を引き起こすのか不明です。スケールが大きく異なる複数の相互作用が本質的に重要な役割を果たすことを「マルチスケール現象」と物理学では定義しますが、高次脳機能はまさに本質的にマルチスケール現象であり、ナノスケールからマクロスケールまでの各階層が原因であり結果でもある複合相関システムとして高次脳機能を実証しなければ真の理解に到達することはできないと考えました。以下に、わたしたちの目指す、マルチスケール精神医学研究を述べます。
プロジェクト#1 精神疾患におけるシナプス病態の多階層解析
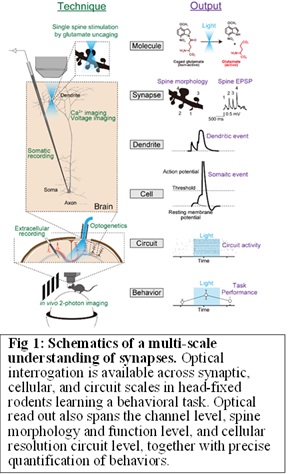 わたしたちの以前の研究で、統合失調症のマウスモデルDISC1ノックダウン(KD)マウスでは、樹状突起スパイン密度の減少することを示しました(Hayashi-Takagi et al., 2010, Nat Neurosci ; Hayashii-Takagi et al., 2014, Proc Natl Acad Sci USA)。また、このモデルでは、野生型マウスと比較して、非常に大きなスパイン(直径0.7 μm以上。以降、巨大スパイン)の数が有意に多いことも分かりました。巨大スパインの存在は、他の確立された統合失調症モデル、カルシニューリンKOマウス(Zeng H et al, 2001, Cell )やSETD1A hKOマウス(Nagahama et al, 2019, Cell Rep )でも認められています。そこでわれわれは、巨大スパインが統合失調症の病態生理に関係するかもしれないという仮説をたて、SETD1A hKOマウスとDISC1 KDマウスの巨大スパイン、神経演算、ワーキングメモリーの関係をマルチスケールで解明することを目指しました(Fig. 1)。その結果、巨大シナプスは神経演算を超線形に増強させ、神経細胞の発火を増加させることがわかりました。巨大スパインの発生確率はワーキングメモリと負の相関があり、巨大スパインの発生を光遺伝学で防ぐとワーキングメモリ障害が回復しました。ワークングメモリの障害は、統合失調症の主となる症状であるので、巨大スパインを除去することは病態生理を緩和できることを示唆したわけです。現在、統合失調症の病態生理学の有力な仮説は、シナプス密度が低下することにより、脳神経回路が疎らになることだと考えられています。しかしながら、今回の結果は、精神疾患のある一群の患者さんに関しては、むしろ強すぎるシナプス(巨大スパイン)によって神経回路の動態が変わってしまうことが原因であることを示唆しており、精神疾患の病態生理を見直す必要性を示しています(Obi-Nagata et al, Science Advances, 2023)。この研究をさらに発展させるために、生きたままの脳のシナプス活動(軸索Ca2+イメージングやiGluSnFRによるシナプス入力の可視化)、神経細胞発火(細胞体Ca2+イメージング)、行動の関係を、疾患モデルマウス(Setd1A hKO、Chd8 hKO、MeCP2 hKO)とin vivo 2光子イメージングを組み合わせて調べています。
わたしたちの以前の研究で、統合失調症のマウスモデルDISC1ノックダウン(KD)マウスでは、樹状突起スパイン密度の減少することを示しました(Hayashi-Takagi et al., 2010, Nat Neurosci ; Hayashii-Takagi et al., 2014, Proc Natl Acad Sci USA)。また、このモデルでは、野生型マウスと比較して、非常に大きなスパイン(直径0.7 μm以上。以降、巨大スパイン)の数が有意に多いことも分かりました。巨大スパインの存在は、他の確立された統合失調症モデル、カルシニューリンKOマウス(Zeng H et al, 2001, Cell )やSETD1A hKOマウス(Nagahama et al, 2019, Cell Rep )でも認められています。そこでわれわれは、巨大スパインが統合失調症の病態生理に関係するかもしれないという仮説をたて、SETD1A hKOマウスとDISC1 KDマウスの巨大スパイン、神経演算、ワーキングメモリーの関係をマルチスケールで解明することを目指しました(Fig. 1)。その結果、巨大シナプスは神経演算を超線形に増強させ、神経細胞の発火を増加させることがわかりました。巨大スパインの発生確率はワーキングメモリと負の相関があり、巨大スパインの発生を光遺伝学で防ぐとワーキングメモリ障害が回復しました。ワークングメモリの障害は、統合失調症の主となる症状であるので、巨大スパインを除去することは病態生理を緩和できることを示唆したわけです。現在、統合失調症の病態生理学の有力な仮説は、シナプス密度が低下することにより、脳神経回路が疎らになることだと考えられています。しかしながら、今回の結果は、精神疾患のある一群の患者さんに関しては、むしろ強すぎるシナプス(巨大スパイン)によって神経回路の動態が変わってしまうことが原因であることを示唆しており、精神疾患の病態生理を見直す必要性を示しています(Obi-Nagata et al, Science Advances, 2023)。この研究をさらに発展させるために、生きたままの脳のシナプス活動(軸索Ca2+イメージングやiGluSnFRによるシナプス入力の可視化)、神経細胞発火(細胞体Ca2+イメージング)、行動の関係を、疾患モデルマウス(Setd1A hKO、Chd8 hKO、MeCP2 hKO)とin vivo 2光子イメージングを組み合わせて調べています。
プロジェクト#2:機能的コネクトミクスのための新規シナプスイメージングの確立
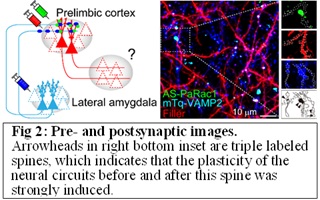 わたしたちは以前、光活性化Rac1(Activated Synapse targeting PhotoActivatable Rac1、以降AS-PaRac1)を利用したシナプス光遺伝学法を開発しました(Hayashi-Takagi et al, 2015, Nature )。AS-PaRac1は、最近増強された樹状突起スパインを特異的に標識できるだけでなく、AS-PaRac1を含むスパインを光依存的に収縮させることができる強力なツールです。しかし、AS-PaRac1の最大の欠点は、増強されたスパインしか標識しないため、そのシナプスがどこから来て、その先はどこへ接続するかという回路情報が得られないことです。この問題を克服するため、われわれは新しい機能的コネクトミクスイメージングの確立を目指します。すなわち、生体脳におけるシナプス前マーカーVamp2、シナプス前部の軸索、増強したスパイン(AS-PaRac1)、およびシナプス後ニューロンの軸索の全てを活動依存的にイメージングする方法です(Fig. 2)。この方法により、膨大で複雑な神経回路の中で、ある特定の神経回路におけるシナプス増強をそれを構成する神経回路網が可視化できるはずです(ファンクショナル・コネクトミクス)。また、ここではまだ説明できませんが、全く光感受性の回路トレースの新手法の確立にも取り組んでいます。興味のある方は、林まで直接お問い合わせください。
わたしたちは以前、光活性化Rac1(Activated Synapse targeting PhotoActivatable Rac1、以降AS-PaRac1)を利用したシナプス光遺伝学法を開発しました(Hayashi-Takagi et al, 2015, Nature )。AS-PaRac1は、最近増強された樹状突起スパインを特異的に標識できるだけでなく、AS-PaRac1を含むスパインを光依存的に収縮させることができる強力なツールです。しかし、AS-PaRac1の最大の欠点は、増強されたスパインしか標識しないため、そのシナプスがどこから来て、その先はどこへ接続するかという回路情報が得られないことです。この問題を克服するため、われわれは新しい機能的コネクトミクスイメージングの確立を目指します。すなわち、生体脳におけるシナプス前マーカーVamp2、シナプス前部の軸索、増強したスパイン(AS-PaRac1)、およびシナプス後ニューロンの軸索の全てを活動依存的にイメージングする方法です(Fig. 2)。この方法により、膨大で複雑な神経回路の中で、ある特定の神経回路におけるシナプス増強をそれを構成する神経回路網が可視化できるはずです(ファンクショナル・コネクトミクス)。また、ここではまだ説明できませんが、全く光感受性の回路トレースの新手法の確立にも取り組んでいます。興味のある方は、林まで直接お問い合わせください。
プロジェクト#3:シナプス分解能を有する新規2軸2光子イメージング法の開発
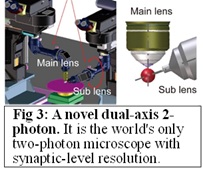 プロジェクト#1と#2の成果をさらに加速させるため、2つの脳領域を同時にイメージングできる高解像度(シナプス分解能)2軸2光子顕微鏡システムを作成しました(Fig. 3)。各領域で異なる色を用いた2色カルシウムイメージングとともに、フィードフォワード、フィードバックやカップリングといった脳の情報処理が、精神医学モデルマウスでどのように変化するかを明らかにしたいと思っています。
プロジェクト#1と#2の成果をさらに加速させるため、2つの脳領域を同時にイメージングできる高解像度(シナプス分解能)2軸2光子顕微鏡システムを作成しました(Fig. 3)。各領域で異なる色を用いた2色カルシウムイメージングとともに、フィードフォワード、フィードバックやカップリングといった脳の情報処理が、精神医学モデルマウスでどのように変化するかを明らかにしたいと思っています。
プロジェクト#4:ヒト標本におけるシナプス解析
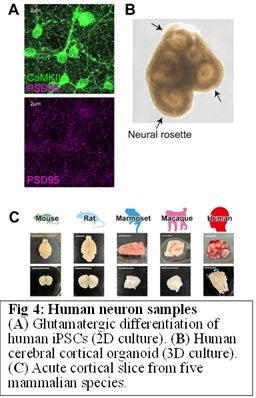 最後の本丸は、私たちがマウスモデルで得てきた知見が、本当にヒトの精神疾患患者の脳で生じているのか、そしてそれが本当に精神疾患の原因なのかどうかを調べることです。マウスで得られた知見とヒトの精神疾患とのギャップを埋めるために、私たちは精神科患者さまの死後脳(ピッツバーグ大学および日本ブレインバンクネットワークより倫理的手続きを踏んで取得)、疾患関連遺伝子変異を持つヒトiPS細胞由来ニューロン(Fig. 4AB)、および脳外科手術で治療的に摘出した悪性腫瘍サンプルの解析に取り掛かりました。グリオーマなどの浸潤性悪性腫瘍は、その浸潤性のために周囲の健常脳組織も切除することが必須であるため、腫瘍断片のほんのすこしの健常脳組織から何とか工夫して急性標本を作製すれば、ヒトの神経細胞の本当の性質が分かるからです。人間を人間たらしめるヒト神経細胞の特異的な点は何か?それを調べるために、齧歯類(マウス、ラット)、非ヒト霊長類(マーモセット、マカクザル)、そしてヒトの大脳皮質の電気生理解析をはじめました(Fig. 4C、理研CBS-慶應大共同研究)。特に詳細な計画については、「10年ビジョン」を参照ください。
最後の本丸は、私たちがマウスモデルで得てきた知見が、本当にヒトの精神疾患患者の脳で生じているのか、そしてそれが本当に精神疾患の原因なのかどうかを調べることです。マウスで得られた知見とヒトの精神疾患とのギャップを埋めるために、私たちは精神科患者さまの死後脳(ピッツバーグ大学および日本ブレインバンクネットワークより倫理的手続きを踏んで取得)、疾患関連遺伝子変異を持つヒトiPS細胞由来ニューロン(Fig. 4AB)、および脳外科手術で治療的に摘出した悪性腫瘍サンプルの解析に取り掛かりました。グリオーマなどの浸潤性悪性腫瘍は、その浸潤性のために周囲の健常脳組織も切除することが必須であるため、腫瘍断片のほんのすこしの健常脳組織から何とか工夫して急性標本を作製すれば、ヒトの神経細胞の本当の性質が分かるからです。人間を人間たらしめるヒト神経細胞の特異的な点は何か?それを調べるために、齧歯類(マウス、ラット)、非ヒト霊長類(マーモセット、マカクザル)、そしてヒトの大脳皮質の電気生理解析をはじめました(Fig. 4C、理研CBS-慶應大共同研究)。特に詳細な計画については、「10年ビジョン」を参照ください。
10年ビジョン
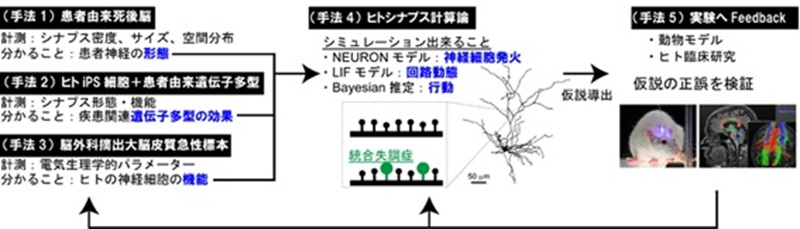
わたしたちの研究は、精神疾患モデルマウスに焦点を当てており、今後もこの戦略を継続する予定です。しかし、この戦略だけでは、ヒトの精神疾患の解明を達成することはできないと考えます。それはマウスだからです。マウスは所詮マウスです。ヒトとは違いますので、マウスだけを研究したとしてもヒト精神疾患を完全解明できるとは思えません。ではヒトサンプルを使用した実験は可能でしょうか?たとえば、電気生理学的手法を使って統合失調症患者さまの脳の神経細胞発火を測定し、幻聴との相関を調べ、関与している可能性のあるシナプスを特定した上で、そのシナプスを光学的に操作することで幻聴を操作できるかどうかを検証したらどうでしょうか?これはマウス実験の王道戦略です。しかし、お分かりのように、このような実験をヒトで行うことは、倫理的に到底不可能な実験です。ではどうしたらいいのでしょうか?わたしは、完全な方法は無いけれども、あらゆる方法を組み合わせることで、それぞれの方法単独の限界を克服することは可能だと考えています。特に、ヒト由来神経細胞、計算論的神経科学、マウス脳科学研究の組み合わせが鍵になるでしょう。ヒト由来サンプルには、患者様からの死後脳、ヒトiPSC由来神経から作製する脳オルガノイド、脳外科手術で摘出された急性脳サンプルが含まれます(Fig. 4)。死後脳では機能的な生理実験はできませんが、精神疾患グループと年齢をマッチさせた対照群のシナプスを形態学的に研究することは可能です。iPS由来の神経細胞は、現在の技術では完全な神経細胞とは言えませんが、この細胞に対する遺伝子操作は容易です。例えば、疾患に関連する遺伝子多型の導入やレスキュー実験も容易で、十分な実験回数で多くの仮説を検証することができます。また、ヒトの本当の神経生理学的特性を測定するために、治療目的で得られたグリオーマサンプルも利用します。グリオーマは浸潤性が高く、周囲の健全な神経組織を除去することが治療上不可欠であるため、健全な神経細胞をほんの少しだけ倫理的に入手することができるからです。実際、これらのサンプルを用いた予備実験では、パッチ・クランプや単一シナプス刺激などの2光子実験が可能であることが分かってきました。最後に、このようなヒトのデータは貴重な洞察を与えてくれますが、それだけではヒトの疾患の理解につながりません。これらの実験はin vitro の結果であり、生きたままの(in vivo )人の脳活動や精神状態との関係を見ることは出来ないからです。そこで、得られた「ヒトのデータ」と「われわれの疑問」とのギャップを埋めるために、計算論的神経科学を活用します。ヒトのデータを数理モデル、具体的にはNEURONモデル、Leaky Integrate-and-Fireモデル、Free Energyモデル等に代入し、ヒトのパラメータを実装した神経モデル、回路モデル、行動モデルを構築したらどうでしょう?これらのシミュレーションにより、新たな洞察が得られるはずです。そして、今後のマウス研究における実験に新たな仮説を提供できます。私は、マウスモデル研究、ヒト由来サンプルを用いた研究、計算論的神経科学という3つの手法を迅速に循環させることが、ヒトの精神医学を理解する上で重要であると考えています。